3. LA ENERGÍA, LA REACIÓN QUÍMICA Y LA
VIDA
La vida de todo ser viviente depende
fundamentalmente de la energía que obtiene a través de los alimentos Esta gran
dependencia de la energía nos obliga a conocer
las leyes que rigen las transformaciones químicas, los cambios de
energía durante los procesos físicos, químicos y biológicos, los aportes
energéticos de las diferentes clases de alimentos, así como los requerimientos
para que se den dichas transformaciones.
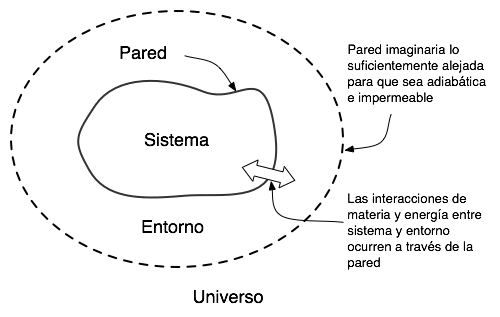
SISTEMAS, ALREDEDORES Y PAREDES O FRONTERAS
Sistema es una porción aislada o
limitada del universo que se somete a investigación en un experimento; todos
los demás objetos que pueden actuar
sobre el sistema se denominan alrededores o medio ambiente del sistema.
La pared o frontera es el medio que separa a un sistema de sus
alrededores. Por ejemplo, cuando se efectúa una reacción química entre
soluciones acuosas en un vaso de precipitados, el contenido del vaso es lo que
constituye el sistema; el vaso constituye la pared mientras que al aire o a
cualquier otra cosa en las vecindades se
les llama los alrededores o medio ambiente del sistema.
Las
paredes que separan a un sistema de sus alrededores se clasifican en: permeables
o impermeables, dependiendo de si permiten o no el intercambio de
materia; rígidas o no rígidas, (es decir, móviles, como un émbolo) y diatérmicas
o adiabáticas dependiendo de si permiten o no el intercambio de calor.
Dependiendo
de las paredes, los sistemas se clasifican en abiertos, cerrados y
aislados.
Un
sistema abierto es el que puede
intercambiar tanto materia como energía con sus alrededores. Cuando el sistema
no puede intercambiar materia con sus alrededores y sólo puede intercambiar
energía o trabajo, se denomina cerrado.
El sistema que no puede intercambiar ni energía ni materia con sus alrededores
se denomina aislado.
SISTEMAS HOMOGÉNEOS Y
HETEROGÉNEOS
Según
el número de fases los sistemas pueden ser homogéneos o heterogéneos. Un sistema
homogéneo es el que contiene una sola fase y el sistema heterogéneo contiene
más de una fase. Una fase se define como una porción uniforme de un
sistema, físicamente distinta del resto del sistema y separada por fronteras
bien definidas, además, puede separarse mecánicamente. Por ejemplo, el sistema hielo y agua,
contenido en un vaso, está constituido por dos fases: la sólida, el hielo y la
líquida, el agua. A la frontera entre dos fases se le denomina interfase.
En el caso del hielo y el agua, la frontera entre el agua y el hielo es la
interfase.
ESTADOS
Y FUNCIONES DE ESTADO
Estado
de un sistema
es la descripción del estado del sistema
y se encuentra definido cuando cada una de sus propiedades tiene un valor
determinado. Para poder especificar sin ambigüedades el estado de un sistema,
es necesario que el sistema esté en equilibrio termodinámico. Esto implica que
la temperatura, la densidad, la presión, etc. sean uniformes a través de todo
el sistema.
En termodinámica se estudian los cambios de estado
de un sistema. Las propiedades macroscópicas que definen el estado de un
sistema como la composición, la temperatura, la energía, el volumen, etc., se
denominan variables de estado o funciones de estado ya que son
propiedades que sólo dependen del estado
en que se encuentra el sistema y no de cómo se llegó a ese estado. Para definir
el estado de un sistema sólo son necesarias cuatro propiedades: masa, volumen, presión y temperatura.
En la ecuación PV=nRT, el número de moles, la
presión, el volumen y la temperatura son funciones de estado y están
relacionadas entre si mediante la ecuación matemática anterior, que recibe el
nombre de ecuación de estado del gas ideal. Sólo se necesitan tres de estas
variables para describir el estado; la cuarta puede calcularse a partir de la
ecuación de estado. Una vez que se especifica el estado del sistema, dando valores
a unas pocas funciones de estado, todas las demás funciones de estado queden
fijadas. La energía también es una función de estado y existen muchas otras. La
termodinámica no considera al tiempo
como variable; lo único que requiere es que las propiedades se midan cuando el sistema ha alcanzado el equilibrio.
CAMBIOS DE ESTADO
Cuando
se altera el estado de un sistema, la
variación que experimenta cualquier función de estado sólo depende de los
estados inicial y final del sistema, y no de la forma en que se produce el
cambio. Por ejemplo cuando cambia el volumen de un gas desde un volumen inicial
V1 hasta un volumen final V2, cualquier valor intermedio que pueda adquirir el volumen durante el cambio desde V1 a V2
carece de importancia y la variación del
volumen DV está dada por:
DV = V2 –V1
El símbolo D (delta) representa la variación de una
magnitud y se calcula restando del valor
final el valor inicial de la magnitud.
PRIMERA
LEY DE LA TERMODINÁMICA.
La
primera ley de la termodinámica se basa en la observación de que no puede
crearse ni destruirse energía en un proceso físico o químico.
La energía es
la capacidad para realizar un trabajo y se clasifica como cinética o de movimiento y potencial o
almacenada. La energía puede transformarse de una forma a otra, pero la
suma de las energías cinética y
potencial permanece constante, aún cuando una de las dos pueda aumentar o
disminuir a expensas de la otra.
Si la energía se conserva, cualquier variación de la
energía total de un sistema tiene que
ser compensada por una variación igual y opuesta de la energía de algún otro
sistema. O sea, que la energía se puede transferir pero nunca crear o destruir.
ENERGÍA INTERNA
La termodinámica trata solamente de las propiedades
macroscópicas de la materia; sin embargo, buscamos una explicación desde el
punto de vista atómico de lo que es la energía interna.
La energía interna de un sistema resulta,
principalmente de la energía cinética de sus moléculas, de la energía potencial
asociada con las fuerzas entre las moléculas, y de la energía cinética y
potencial de los electrones y de los núcleos en las moléculas. Cuando cambia la
energía interna de un sistema, cambian todas o algunas de las contribuciones a
la energía.
CALOR Y TRABAJO
El calor es la energía transmitida a causa de
una diferencia de temperatura entre un
sistema y sus alrededores. Los cambios de temperatura se pueden relacionar con cambios de energía interna del sistema.
El trabajo es energía transmitida por medio de una
conexión mecánica entre el sistema y sus alrededores. En termodinámica el
trabajo tiene un sentido más amplio, que incluye además del trabajo mecánico,
otros tipos de trabajo, como el eléctrico. En esta sección sólo se hará
referencia al trabajo mecánico. El trabajo se puede definir como fuerza por
distancia:
w
= F x d
Para
ejemplificarlo, supóngase un gas contenido en un cilindro a cierta temperatura,
presión y volumen, con un pistón móvil, libre
de fricción y peso.
Si
el gas se expande, empujará el pistón hacia arriba contra la presión
atmosférica P que es constante. El
trabajo realizado por el gas sobre los alrededores tiene signo menos ya que el
sistema gaseoso fue el que realizó el trabajo al empujar el pistón contra la
presión externa:
w
= ─ PΔV ΔV = Vf
- Vi
La
ecuación anterior se explica al considerar que la presión x
el volumen puede considerarse como (fuerza / área) x volumen
P x V = F/d2 x d3 = F x
d = w
Presión
volumen
Cuando hay un incremento de volumen, el trabajo
realizado por el sistema gaseoso depende de la magnitud de la presión externa. Si se realiza una expansión sin que exista
una presión de oposición, es decir, contra el vacío, entonces el trabajo es
nulo.
Si se realiza un trabajo sobre sistema, éste gana
una cantidad de energía, la cual, en el caso de no haber pérdidas por fricción
que produzcan una pérdida por calor, es exactamente equivalente a la cantidad
de trabajo que se realizó.
La unidad que resulta al
multiplicar presión x volumen es L
atm, esta expresión es menos familiar, puesto que el trabajo o la
energía se expresan habitualmente en unidades de, joules o calorías. Una
atmósfera litro de trabajo es equivalente:
1 L atm = 101.3 J = 24.2
calorías
La
unidad de energía del sistema internacional
(SI) es el Joule, se define como la fuerza de un Newton que actúa a lo
largo de un metro. La unidad de energía empleada con anterioridad era la
caloría. Una caloría es la cantidad de calor necesaria para elevar en un grado
Celsius un gramo de agua de 14.5 ºC a 15.5 ºC. La equivalencia entre caloría y
Joules es:
1 cal = 4.18 Joules
ECUACIÓN DE LA PRIMERA LEY DE LA TERMODINÁMICA
Si se agrega una cantidad de calor “q” a un sistema y no ocurre ningún
otro cambio, la energía interna del sistema aumenta en una cantidad que es
exactamente igual a la cantidad de calor suministrada.
ΔU
= “q “
Si una cantidad de trabajo “w” se realiza sobre el
sistema y no se transfiere calor a los alrededores, la cantidad de energía
ganada, por el sistema, es igual al trabajo realizado.
ΔU = “w”
Por ejemplo, se puede aumentar la temperatura de un
litro de agua en 5°C al suministrar calor al agua o realizar un trabajo con
fricción, mediante un dispositivo como el de la figura siguiente:
En general, si se suministra calor “q”
al sistema y al mismo tiempo se realiza una cantidad “w” de trabajo sobre éste,
el aumento de energía interna está dado por:
ΔU = q + w cambio calor trabajo hecho
de energía agregado
sobre el sistema
interna
La ecuación anterior es la expresión matemática de
la primera ley de la termodinámica.
En caso de que el sistema realice un trabajo sobre
los alrededores, la energía interna de éste disminuye, como sucede con los
gases que al expandirse empujan un pistón; en donde “w” es negativo y se tendrá:
ΔU = q – w cambio de
calor trabajo hecho
energía agregado
por el sistema
interna
Es importante tener presentes las convenciones
relativas a los signos del calor y el trabajo:
“q” positivo = calor absorbido o ganado
por el sistema
“q” negativo = calor desprendido o
perdido por el sistema
“w” positivo = trabajo realizado sobre el
sistema
“w” negativo = trabajo realizado por el
sistema sobre los alrededores
VARIACIÓN DE LA ENERGÍA INTERNA DURANTE LAS REACCIONES QUÍMICAS
Cada sustancia tiene una energía interna característica que se conoce como contenido energético. Cada mol de una
sustancia tiene un contenido
energético característico, de la misma
manera que tiene una masa
característica. Al transformarse los reactivos
en productos durante un cambio químico, se desprende o se absorbe calor
debido a que el contenido
energético de las substancias respectivas es diferente. Este intercambio
energético que acompaña a una
reacción química se denomina calor de reacción y se determina
experimentalmente. La siguiente gráfica muestra que el calor de reacción
absorbido, cundo se descompone un mol de
agua, es igual al calor desprendido cuando se forma un mol de agua.
Reacciones exotérmicas y reacciones endotérmicas.
Si en una reacción se
desprende calor , ΔU es negativo, y significa que la energía de los productos es menor que la energía de los reactivos, como sucede
en las reacciones de combustión. Las
reacciones que desprenden calor se denominan exotérmicas.
ΔU = U productos – U reactivos
ΔU < 0
Si ΔU es negativo, se desprende calor y la reacción es exotérmica.
Si durante una
reacción se absorbe calor, ΔU es
positivo y
significa que la energía de los productos es mayor que la de los reactivos,
como en la fotosíntesis. Las reacciones que absorben calor se llaman endotérmicas.
ΔU = U productos – U reactivos ΔU
> 0
Si ΔE es positivo, se absorbe
calor y la reacción es endotérmica.